Lecture - 12 Micropropagation, callus culture, cell suspension culture, haploid culture, somatic embryogenesis
Micro propagation technology (सूक्ष्म प्रवर्धन प्रौधौगिकी):-
1. सामान्य परिचय (General Introduction):-
· क्लोनीय प्रवर्धन (Clonal Propagation):- अलैंगिक जनन द्वारा एक पौधे की आनुवांशिक रूप से एक समान संततियाँ उत्पन्न करके गुणन करने की प्रक्रिया को क्लोनीय प्रवर्धन कहते हैं।
(The process of multiplication by producing genetically identical offspring of a plant by asexual reproduction is called clonal propagation.)
· प्राकृतिक क्लोनीय प्रवर्धन अधिक कठिन, खर्चीला व असफल होता है।
(Natural clonal propagation is more difficult, expensive, and unsuccessful.)
· परिभाषा (Definition):- पादप के कायिक भाग को कर्तोतक के समान उपयोग करके निर्जमित परिस्थितियों में कृत्रिम माध्यम पर संवर्धन करने की प्रक्रिया को सूक्ष्म प्रवर्धन कहते हैं। अर्थात क्लोनीय प्रवर्धन की कृत्रिम विधि को सूक्ष्म प्रवर्धन कहते हैं।
(The process of culturing the vegetative part of the plant as explant on culture medium under sterilized conditions is called micro propagation. That is, the artificial method of clonal propagation is called micro propagation.)
· क्लोन शब्द का प्रयोग सबसे पहले Weber ने किया था।
(The term clone was first used by Weber.)
· सूक्ष्म प्रवर्धन में बहुत कम जगह और बहुत कम समय में एक पौधे से बहुत अधिक संख्या में सूक्ष्म कायिक प्ररोह बना लिए जाते हैं।
(Very large number of minute vegetative shoots are produced from a plant in very little space and in a very short time in micro propagation.)
· सूक्ष्म प्रवर्धन के लिए ऊतक संवर्धन का उपयोग G. Morel ने 1960 में शुरू किया था। उसने ओर्किड प्रवर्धन के लिए इसका उपयोग किया था।
(The use of tissue culture for micro-propagation started in 1960 by G. Morel. He used it for orchid propagation.)
2. सूक्ष्म प्रवर्धन विधियाँ (Micro propagation Methods):-
i. प्ररोह शीर्षस्थ विभाज्योतक द्वारा गुणन (Multiplication by Shoot Apical Meristem)
ii. अपस्थानिक प्ररोह द्वारा गुणन (Multiplication by Adventitious Shoot)
iii. अपस्थानिक भ्रूण निर्माण द्वारा गुणन (Multiplication by Adventitious Embryo Formation)
iv. कैलस संवर्धन द्वारा गुणन (Multiplication by Callus Culture)
3. सूक्ष्म प्रवर्धन की अवस्थाएँ (Stages of Micro propagation):-
सूक्ष्म प्रवर्धन को 5 अवस्थाओं में विभाजित किया गया है –
(Micro propagation is divided into 5 stages -)
a. अवस्था – 0 (Stage - 0)
b. अवस्था – I (Stage - I)
c. अवस्था – II (Stage - II)
d. अवस्था – III (Stage - III)
e. अवस्था – IV (Stage - IV)
a. अवस्था – 0 (Stage - 0):-
यह सूक्ष्म प्रवर्धन का प्रारम्भिक चरण है जिसमें स्टॉक पौधों का चयन करके लगभग 3 महीने के लिए नियंत्रित परिस्थितियों में उगाया जाता है। जिससे पौधे पूर्ण रूप से स्वस्थ व ओजपूर्ण हो जाते हैं।
(This is the initial stage of micro propagation in which stock plants are selected and grown under controlled conditions for about 3 months. Due to which the plant becomes completely healthy and vigorous.)
b. अवस्था – I (Stage - I):-
· इस अवस्था में स्वस्थ पौधे से कर्तोतक को लेकर उपयुक्त संवर्धन माध्यम पर स्थापित कर दिया जाता है।
(In this stage, the explants are taken from a healthy plant and are established on the appropriate culture medium.)
· सूक्ष्म प्रवर्धन के लिए मुख्यत: 2 माध्यम उपयुक्त होते हैं –
(There are mainly 2 mediums suitable for micro propagation -)
i. MS माध्यम (MS medium)
ii. White माध्यम (White medium)
· इस अवस्था में निम्न चरण होते हैं –
(This stage consists of the following steps -)
i. कर्तोतक का पृथक्करण (Isolation of Explant)
ii. सतही निर्जमीकरण (Surface Sterilization)
iii. सफाई (Washing)
iv. उपयुक्त संवर्धन माध्यम पर कर्तोतक की स्थापना (Establishment of Explant on Appropriate Culture Medium)
· इस अवस्था में माध्यम में Kinetin व NAA या IBA वृद्धि नियामक मिश्रित किए जाते हैं जो वृद्धि व विकास को प्रेरित करते हैं।
(At this stage, kinetin and NAA or IBA growth regulators are mixed in the medium to induce growth and development.)
c. अवस्था – II (Stage - II):- इस अवस्था में सूक्ष्म प्रवर्धन की मुख्य क्रिया होती है। इसमें कर्तोतक की वृद्धि होती है तथा भ्रूण का निर्माण होता है।
(In this stage, the main activity of micro propagation takes place. In this, there is growth of explant and formation of embryo occurs.)
d. अवस्था – III (Stage - III):-
· कर्तोतक के भ्रूण में परिवर्तन के दौरान माध्यम में उपस्थित पोषक पदार्थों का उपयोग हो जाता है, जिससे भ्रूण का आगे का परिवर्धन धीमा हो जाता है।
(During development of embryo from explant, nutrients present in the medium are used, which further slows down the embryo's further development.)
· इसलिए इस अवस्था में हम भ्रूण को पुराने माध्यम से निकालकर नए माध्यम में स्थानांतरित कर देते हैं ताकि भ्रूण शीघ्रता से प्ररोह में विकसित हो सके। इसे उप – संवर्धन भी कहते हैं।
(Therefore, in this stage we remove the embryo from the old medium and transfer it to the new medium so that the embryo can develop into shoots quickly. It is also called sub-culturing.)
· इस अवस्था में माध्यम में Kinetin की उच्च मात्रा डालते हैं।
(In this stage high amount of kinetin is added to the medium.)
· तापमान 24 – 26°C रखा जाता है तथा प्रकाश की तीव्रता कम राखी जाती है।
(The temperature is kept at 24 - 26 ° C and the intensity of light is kept low.)
· नए माध्यम में भ्रूण का शीघ्रता से प्ररोह में विकास हो जाता है जिससे प्लांटलेट्स बन जाते हैं।
(In the new medium, the embryo develops quickly in shoots, forming plantlets.)
e. अवस्था – IV (Stage - IV):-
· इस अवस्था में हम प्लांटलेट्स को आगे के परिवर्धन के लिए मृदा में स्थापित करते हैं।
(In this stage we establish the plantlets in the soil for further development.)
· हम प्लांटलेट्स को लैब के वातावरण से निकालकर ग्रीन हाउस के वातावरण में स्थानांतरित करते हैं। जहां इनकी हार्डनिंग की जाती है।
(We transfer the plantlets from the lab environment to the greenhouse environment. Where they are hardened.)
4. लाभ (Advantages):-
· कायिक प्रवर्धन की एकांतरित विधि है।
(This is an alternative method of vegetative propagation.)
· तीव्र विधि है। कम समय में कम जगह पर बहुत अधिक संख्या में पौधे विकसित किए जा सकते हैं।
(This is fast method. A large number of plants can be developed in a small space and least time.)
· प्ररोह गुणन का 2 – 6 सप्ताहों का एक छोटा चक्र होता है तथा प्रत्येक चक्र में प्ररोहों की संख्या में लघुगणकीय वृद्धि होती है।
(The shoot multiplication has a short cycle of 2 - 6 weeks and there is a logarithmic increase in the number of shoots in each cycle.)
· बल्ब, कन्द या घनकन्द उत्पादित पौधों में यह अधिक लाभकारी है क्योंकि छोटे बल्ब, कन्द या घनकन्द पादप गुणन के लिए सम्पूर्ण वर्ष उपलब्ध रहते हैं।
(It is more beneficial in plants producing bulbs, tubers or corms because small bulbs, tubers or corms remain available throughout the year for plant multiplication.)
· छोटे आकार के प्रवर्ध अधिक लाभकारी होते हैं क्योंकि भंडारण व परिवहन में यह कम जगह घेरते हैं।
(Small sized propagules are more beneficial because they occupy less space in storage and transport.)
· सूक्ष्म प्रवर्धों का अनुरक्षण मृदा रहित वातावरण में किया जा सकता है जो बड़े स्तर पर इनके भंडारण में सहायता करता है।
(Micro-propagation can be maintained in a soil-free environment, which helps in storing them on a large scale.)
· स्टॉक पौधों के जननद्रव्य को अनेक वर्षों तक अनुरक्षित किया जा सकता है।
(The germplasm of stock plants can be maintained for many years.)
· रोग मुक्त पौधों का उत्पादन किया जा सकता है।
(Disease-free plants can be produced.)
· एकलिंगाश्रयी पौधे (Dioecious plants):- इनकी बीज संततियाँ 50% नर व 50% मादा होती हैं। सूक्ष्म प्रवर्धन से वांछित संततियाँ (नर या मादा) उत्पन्न की जा सकती हैं।
(Their seed progenies are 50% male and 50% female. Desired offspring (male or female) can be produced by micro propagation.)
· वाणिज्यिक नर्सरियों में सूक्ष्म प्रवर्धन के लिए कम से कम स्थान की आवश्यकता होती है। संवर्धन ट्यूब्स में हजारों प्लांटलेट्स को अनुरक्षित किया जा सकता है। यह बागवानी जातियों के अनुरक्षण में उपयोगी है।
(Commercial nurseries require minimal space for micro propagation. Thousands of plantlets can be maintained in culture tubes. It is useful in maintaining horticultural species.)
· धीमी वृद्धि वाले पौधों में यह विधि अधिक उपयोगी है। ऐसे पौधों में बीज कई वर्षों के पश्चात उत्पन्न होते हैं। इनमें बीज ही केवल प्रवर्ध होते हैं।इस विधि के उपयोग से प्रवर्धों की उपलब्धता में कठिनाई को दूर किया जा सकता है।
(This method is more useful in slow growth plants. Seeds in such plants are produced after many years. Seeds are only propagules in them. The difficulty in the availability of propagules can be overcome by the use of this method.)
· बीज उत्पादन से 100% एकसमान संतति उत्पन्न करना हमेशा संभव नहीं है। सूक्ष्म प्रवर्धन के द्वारा यह संभव है।
(It is not always possible to produce 100% identical offspring from seed production. This is possible through micro propagation.)
· पुनर्योजी DNA तकनीक या अगुणित संवर्धन या कायिक संकरण द्वारा उत्पन्न नई ऊतक सामग्री का सूक्ष्म प्रवर्धन द्वारा गुणन किया जा सकता है।
(New tissue material developed by recombinant DNA technology or haploid culture or somatic hybridization can be multiplied by micro-propagation.)
Callus Culture:-
1. Introduction:-
· Callus:- The non-specific and unorganized group of cells growing by mitosis is called callus.
· Callus is produced when the explant is cultured on a solid agar medium containing the suitable amount of auxin and cytokinin. 2,4 - D is commonly used as auxin.
· There is some degree of dedifferentiation in morphology and metabolism during callus formation. Due to which they lose the ability of photosynthesis.
· Callus is a blob of tissue in which most cells are undifferentiated.
· Callus develops naturally when there is a wound in a plant.
· Callus Culture:- When the callus is cultured on artificial solid agar medium in sterilized conditions, it is called callus culture.
2. History:-
· R. J. Gautheret (1934-37):- He first succeeded in developing callus from the cambium of the Salix capraea plant.
· P. Nobecourt (1939):- He first established the callus culture having unlimited growth potential on a solid agar medium. He started work on the tap root of Daucus carota.
· J. Van Overbeck, M. E. Conklin and A. F. Blakeslee (1941):- He first discovered the importance of coconut milk in callus culture.
· S. M. Caplin and F. C. Steward (1948):- They succeeded in achieving growth on a medium containing coconut milk by isolating differentiated non - cambial cells from carrot.
· F. Skoog (1954-1955):- He succeeded in obtaining callus culture from a piece of tobacco stem cutting on a auxin containing medium. Callus remained active for some time and failed to grow.
· F. Skoog and C. O. Miller (1957):- He first introduced the concept of hormonal control of organ formation from callus tissue. They reported that equal amounts of auxin and kinetin in the medium stimulate the continuous growth of callus tissue.
3. Principle:- Three important requirements must be met for a successful initiation of callus culture -
i. Preparation of plant material under sterilized conditions. Surface sterilization is done for this.
ii. Selecting the appropriate nutrient medium in which auxin and cytokinin are present in appropriate proportion. There should be a ratio of 1: 1 for callus growth.
iii. Incubation of culture under controlled physical conditions.
Ø It is necessary to have controlled conditions of heat, light and humidity present for the correct initiation of callus tissue formation.
Ø A temperature of 25 ± 2 ° C is considered appropriate.
Ø In some plants, 24 hours of darkness is required for developing callus such as carrot. Other plants require 16 hours of light period and 8 hours of dark period. The intensity of artificial light should be 2000 to 3000 lux. Cold and white lamps are used to provide artificial light.
Ø Generally 55 to 60% relative humidity is maintained in the culture chamber.
Haploid Culture:-
Anther Culture:-
1. Introduction:-
· Definition:- It is an artificial technique by which the developing anthers are collected from a closed floral bud at a fine and delicate stage and cultured on a nutrient medium. Where the microspores develop into callus tissue or embryo like structure, that develop haploid plants through organ formation or embryo formation.
· So far anthers have been cultured in about 250 plant species. The three families are more common -
i. Solanaceae
ii. Criciferae
iii. Poaceae
2. History:-
· W. Tulecke (1953):- He first observed that mature pollens of the gymnosperm plant Ginkgo biloba can be induced to form haploid callus in culture.
· S. Guha and P. Maheshwari (1964):- They first observed that the embryos are developed from the microspores directly in anther culture of Datura innoxia.
· J. P. Bourgin and J. P. Nitsch (1967):- They obtained fully haploid plants by the anther culture of tobacco (Nicotiana tabacum).
· Niizeki and Oono (1968):- They were Japanese scientists. They developed haploid plants for plant breeding by anther culture in paddy.
3. Principle:-
· The haploid plant is produced using the totipotency of the microspore.
· Only one set of chromosomes is present in the microspore.
· In the process of haploid plant development, the normal growth and functioning of the microspore of developing male gametes is halted. It is forced into a new metabolic pathway for somatic cell division.
· Anther culture does not alter the natural habitat and environment of the microspores present inside the anther. In culturing conditions, the diploid tissue of the anther survives on the medium without cell division and induces somatic cell division of the microspore by providing nutrition.
Pollen Culture:-
1. Introduction:-
· Definition:- Pollen grain or microspore culture is an artificial process in which pollens or microspores are extracted from the intact anther at its uni-nucleated state and cultured on the nutrient medium under sterilized conditions.
· Androgenesis:- The process of artificial development of haploid plants by a series of cell division and differentiation from a totipotent pollen is called androgenesis. It is of two types -
i. Direct Androgenesis:- The microspore behaves like a zygote and by some changes the it forms a embryo like structure which further develops into haploid plants. This is called embryogenesis.
ii. Indirect Androgenesis:- The microspore divides repeatedly to form the callus tissue. Differentiation leads to development of haploid plant. This is called organogenesis.
2. Principle:-
· The haploid plant is developed using the totipotency of the microspore.
· Only one set of chromosomes is present in the microspore.
· In the process of haploid plant development, the normal development and function of the microspore of the male gametes formation stops. It is forced into a new metabolic pathway for somatic cell division.
· In pollen culture, diploid somatic cells of the anther also sometimes become active under culturing conditions and grow to form unwanted diploid callus or plantlets. Sometimes the chimera is formed. A callus or plantlet whose some cells are haploid and some cells are diploid, is called chimera. To avoid this problem, free pollens extracted from the anthers are cultured on the nutrient medium.
1. सामान्य परिचय (General Introduction):-
· कायिक भ्रूणजनन (Somatic Embryogenesis):- कायिक कोशिका से कायिक भ्रूण के निर्माण की प्रक्रिया को कायिक भ्रूणजनन कहते हैं।
(The process of the development of a somatic embryo from a somatic cell is called somatic embryogenesis.)
· भ्रूणाभ (Embryoid):- जाइगोटिक भ्रूण की तुलना में कायिक भ्रूण छोटा व सुसंगठित संरचना होता है जिसे भ्रूणाभ कहते हैं।
(In comparison to the zygotic embryo, the somatic embryo is a small and well-organized structure called the embryoid.)
2. इतिहास (History):-
· J. Reinert (1958-59):- इसने सबसे पहले गाजर में कृत्रिम कायिक भ्रूणजनन को देखा।
(He first observed artificial somatic embryogenesis in carrot.)
· F. C. Steward, M. O. Mapes and K. Mears (1958):-
इन्होने गाजर में स्वतंत्र निलंबित कोशिकाओं से कायिक भ्रूणजनन को देखा। इन्होने कायिक भ्रूणजनन में नारियल पानी(Coconut milk) के महत्व को बताया।
(They observed somatic embryogenesis from freely suspended cells in carrot. He explained the importance of coconut water in somatic embryogenesis.)
· N. S. Rangaswamy (1961):- इसने नींबू में कायिक भ्रूणजनन का विस्तार से अध्ययन किया।
(He studied the somatic embryogenesis in lemon in detail.)
· R. N. Konar and K. Nataraja (1969):- इन्होने Ranunculus sceleratus के विभिन्न पुष्पीय भागों व कायिक ऊतकों को लेकर कायिक भ्रूणजनन का अध्ययन किया।
(He studied somatic embryogenesis by taking different floral parts and somatic tissues of Ranunculus sceleratus.)
· P. V. Ammirato (1974):- इसने Carum carvi की कोशिकाओं से विकसित हो रहे कायिक भ्रूणो पर ऐब्सिसिक अम्ल के प्रभाव का अध्ययन किया।
(He studied the effect of abscisic acid on somatic embryos developing from Carum carvi cells.)
3. सिद्धान्त (Principle):-
· जाइगोटिक भ्रूण व कायिक भ्रूण दोनों परिवर्धन का समान पैटर्न प्रदर्शित करते हैं।
(Both zygotic embryos and somatic embryos exhibit similar patterns of development.)
· एकबीजपत्री पादपों में दोनों प्रकार के भ्रूण आदर्श रूप से निम्न विकासीय अवस्थाओं से होकर गुजरते हैं –
(In monocot plants both types of embryos typically pass through the following developmental stages -)
i. ग्लोबुलर अवस्था (Globular Stage)
ii. स्कुटैलर अवस्था (Scutellar Stage)
iii. कोलिओप्टाइलर अवस्था (Coleoptilar Stage)
· द्विबीजपत्री व कोनिफर पादपों में दोनों प्रकार के भ्रूण आदर्श रूप से निम्न विकासीय अवस्थाओं से होकर गुजरते हैं –
(In dicot and conifer plants, both types of embryos typically pass through the following developmental stages -)
i. ग्लोबुलर अवस्था (Globular Stage)
ii. हिरद्य अवस्था (Heart Stage)
iii. टॉरपीडो अवस्था (Torpedo Stage)
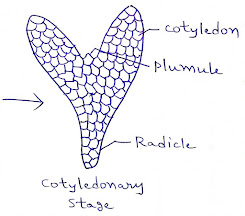
iv. बीजपत्रीय अवस्था (Cotyledonary Stage)
· भ्रूण विकास द्विध्रुवीय होता है। एक सिरे पर प्ररोह व विपरीत सिरे पर मूल निर्माण के लिए ऊतक होता है।
(Embryo development is bipolar. There is one end for shoot formation and the opposite end for root formation.)
· प्रारम्भिक कोशिका में एक असमान विभाजन होता है जिससे एक छोटी व एक बड़ी कोशिका बनती है। बड़ी कोशिका रिक्तिकामय होती है। छोटी कोशिका सघन कोशिकाद्रव्य युक्त होती है जिसे भ्रूणजनित कोशिका कहते हैं।
(The initial cell undergo an unequal cell division, forming a small and a large cell. A large cell is vacuolated. The small cell contains dense cytoplasm called embryonic cells.)
· अब भ्रूणजनित कोशिका 2 प्रकार से विभाजन कर सकती है-
(Now embryonic cells can divide in 2 ways-)
i. अनियमित विभाजनों द्वारा कैलस ऊतक का निर्माण कर सकती है।
(Callus tissue can be formed by irregular cell divisions.)
ii. नियमित व अधिक सुसंगठित विभाजनों द्वारा कायिक भ्रूण का निर्माण कर सकती है।
(By regular and more organized cell divisions, the somatic embryo can form.)
· बाद में मूल शिखाग्र व प्ररोह शिखाग्र बन जाते हैं और ग्लोबुलर अवस्था विकसित हो जाती है। इसके पश्चात अन्य अवस्थाओं से होता हुआ भ्रूण परिपक्वता की ओर बढ़ता है।
(Later the root apex and shoot apex are formed and the globular stage develops. After this, the embryo goes towards maturity through other stages.)
· जाइगोटिक भ्रूणजनन में भ्रूण परिपक्व हो जाता है और निम्न लक्षण प्रदर्शित करता है –
(In zygotic embryogenesis, the embryo matures and exhibits the following characteristics -)
i. परिपक्व भ्रूण आकारिकी
(Mature Embryo Morphology)
ii. संग्रहित कार्बोहाइड्रेट्स, लिपिड्स व प्रोटीन्स का जमाव
(Accumulation of storage carbohydrates, lipids and proteins)
iii. जल की मात्रा में कमी
(Reduction in water content)
iv. उपापचयन में क्रमिक कमी
(Gradual decline of metabolism)
· सामान्यतया कायिक भ्रूण पूर्ण रूप से परिपक्व नहीं होता है। इसकी बजाय वातावरणीय कारकों के कारण कायिक भ्रूण अपने सामान्य विकासीय पैटर्न से विचलित हो जाता है जिसके 3 भविष्य हो सकते हैं –
(Normally the somatic embryo is not fully mature. Instead, due to environmental factors, the somatic embryo deviates from its normal developmental pattern, which can have 3 fates -)
i. कैलस उत्पन्न कर सकता है।
(Callus can be produced.)
ii. प्रत्यक्ष द्वितीयक भ्रूणजनन कर सकता है।
(May perform direct secondary embryogenesis.)
iii. असामयिक रूप से अंकुरित हो सकता है।
(May germinate before maturation.)
· कायिक भ्रूणजनन 2 प्रकार से हो सकता है–
(There are two types of somatic embryogenesis-)
a. प्रत्यक्ष भ्रूणजनन (Direct Embryogenesis)
b. अप्रत्यक्ष भ्रूणजनन (Indirect Embryogenesis)
a. प्रत्यक्ष भ्रूणजनन (Direct Embryogenesis):- जब कर्तोतक की कोशिकाएं कैलस न बनाकर सीधे भ्रूण में परिवर्धित हो जाती हैं तो इसे प्रत्यक्ष भ्रूणजनन कहते हैं। यह बहुत कम देखने को मिलता है। उदाहरण – ओरचार्ड घास (Dactylis glomerata) के संवर्धन में पर्ण मध्योतक कोशिकाओं से सीधे कायिक भ्रूणो का निर्माण होता है।
(When the cells of the explant do not form a callus and develop directly into an embryo, it is called direct embryogenesis. This is rarely seen. Example - In culturing of Orchard grass (Dactylis glomerata), somatic embryos are produced directly from the mesophyll cells.)
b. अप्रत्यक्ष भ्रूणजनन (Indirect Embryogenesis):- जब कर्तोतक की कोशिकाएं पहले कैलस में विकसित होती हैं और फिर कैलस की किसी एक भ्रूणजनित कोशिका से कायिक भ्रूण परिवर्धित होता है तो इसे अप्रत्यक्ष भ्रूणजनन कहते हैं। यह बहुत अधिक देखने को मिलता है।
(When the explant cells first develop into a callus and then the somatic embryo develops from one of the embryonic cell of the callus, it is called indirect embryogenesis. It is most commonly seen.)
4. विधि (Procedure):- कायिक भ्रूणजनन को प्रेरित करने के लिए पादप सामग्री के रूप में गाजर एक आदर्श उदाहरण है।
(Carrot is an ideal example of plant material to induce somatic embryogenesis.)
· कर्तोतक के रूप में गाजर के निम्न भागों का उपयोग कर सकते हैं –
(We can use the following parts of carrot as an explant -)
i. निर्जमित रूप से विकसित 7 दिन पुराने अंकुरों से 0.5 – 1.0 cm पर्णवृन्त का टुकड़ा अथवा 1cm मूल का टुकड़ा ले सकते हैं।
(We can take a piece of 0.5 - 1.0 cm petiole or a piece of 1cm root from aseptically grown 7-day-old seedlings .)
ii. सतही निर्जमित संग्रहित मूसला मूल से 0.5cm3 केम्बियम ऊतक का उपयोग कर सकते हैं।
(We can use 0.5cm3 cambium tissue from the surface sterilized storage tap root.)
· निर्जमित तकनीकों का उपयोग करते हुए कर्तोतकों को एकल रूप से एक अर्धठोस MS माध्यम पर स्थापित करते हैं जिसमें 0.1mg/L 2,4-D व 2% सुक्रोज उपस्थित हो। इन संवर्धनों का अंधेरे में ऊष्मायन किया जाता है। इस माध्यम में कर्तोतक प्रयाप्त मात्रा में कैलस ऊतक उत्पादित करते हैं।
(By using sterilized techniques, the explants are singly placed on a semi-solid MS medium containing 0.1mg / L 2,4-D and 2% sucrose. These cultures are incubated in the dark. In this medium, the explants produce sufficient amount of callus tissue.)
· कैलस वृद्धि के 4 सप्ताहों पश्चात 0.2gm कैलस ऊतक लेकर 250ml फ्लास्क में उपस्थित 20 - 25ml समान संघटन के अगार रहित द्रव माध्यम में स्थानांतरित करके कोशिका निलंबन संवर्धन को शुरू करते हैं। अब इन फ्लास्कों को गायरेटरी शेकरों पर रखकर 125 – 160 RPM पर घुमाकर 25°C ताप पर ऊष्मायन करते हैं। इस अवस्था पर प्रकाश की उपस्थिति या अनुपस्थिति नाजुक नहीं होती है।
(After 4 weeks of callus growth, cell suspension culture is initiated by transferring 0.2gm of callus tissue into a 20 - 25ml of uniform fluid medium present in 250ml flask. Now, these flasks are incubated at 25 ° C by placing them on the gyratory shakers and rotating them at 125 - 160 RPM. The presence or absence of light is not critical at this stage.)
· प्रत्येक 4 सप्ताह में कोशिका निलंबन से 5ml लेकर 65ml ताजा द्रव माध्यम में उप संवर्धित करते हैं।
(In every 4 weeks the cell suspension is sub cultured by adding 5ml into 65ml fresh liquid medium.)
· एक समान भ्रूण समष्टि निर्माण को प्रेरित करने के लिए कोशिका निलंबन को स्टेनलैस स्टील की बनी मैश छलनियों की एक श्रंखला से गुजारा जाता है। गाजर के लिए 74µm छिद्र आकार की छलनी एकल कोशिका व अनेक छोटे कोशिकीय गुच्छों युक्त निलंबन उत्पन्न करती है।
(The cell suspension is passed through a series of stainless steel mash sieves to induce the formation of uniform embryo population. A 74µm pore size sieves for carrot produces a suspension containing single cells and several small cellular clusters.)
· कायिक भ्रूणजनन को प्रेरित करने के लिए छनित कोशिका निलंबन के एक भाग को 2,4-D रहित द्रव माध्यम में स्थानांतरित करते हैं अथवा 2,4-D रहित अर्धठोस माध्यम पर स्थापित करते हैं। अब माध्यम में 0.1 - 1µm ABA डालते हैं जो 2 कार्य करता है –
(To induce somatic embryogenesis, transfer a portion of the filtered cell suspension to a 2,4-D-free liquid medium or place it on 2,4-D-free semi-solid medium. Now we put 0.1 - 1µl ABA in the medium which does 2 things -)
i. सामान्य भ्रूण निर्माण को प्रेरित करता है।
(Induces normal embryo formation.)
ii. असामयिक अंकुरण, विशेष रूप से मूल निर्माण, को रोकता है।
(Prevents premature germination, especially root formation.)
· संवर्धनों का अंधेरे में ऊष्मायन किया जाता है।
(Cultures are incubated in the dark.)
· 3 - 4 सप्ताहों के पश्चात प्रत्येक संवर्धन में अनेक कायिक भ्रूण बन जाते हैं जो अलग अलग विकासीय अवस्था में होते हैं।
(After 3–4 weeks, each culture has several somatic embryos which are in different developmental stages.)
· पादपक निर्माण के लिए कायिक भ्रूणो को 2,4-D रहित अगार माध्यम पर स्थापित किया जाता है।
(For plantlets production, somatic embryos are placed on a 2,4-D free-agar medium.)
· आगे के परिवर्धन के लिए पादपकों को छोटे गमलों या वर्मीकुलाइट में स्थानांतरित कर दिया जाता है।
(Plantlets are transferred to small pots or vermiculites for further development.)
5. महत्व (Importance):-
· अपस्थानिक भ्रूणो का बड़े पैमाने पर उत्पादन किया जाता है।
(Adventitious embryos are produced on a large scale.)
· अपस्थानिक भ्रूण द्विध्रुवीय होते हैं जो सीधे सम्पूर्ण पादपक का निर्माण करते हैं। अलग से मूल निर्माण माध्यम की आवश्यकता नहीं होती है।
(The adventitious embryos are bipolar which directly develop into the entire plant. A separate root formation medium is not required.)
· कायिक भ्रूणो में संग्रहित भोजन नहीं होता है। इनके कैप्सूलिकरण से कृत्रिम संश्लिष्ट बीजों का निर्माण किया जाता है।
(Somatic embryos do not contain stored food. Artificial synthetic seeds are produced by their encapsulation.)
· अंगजनन के विपरीत कायिक भ्रूण एकल कोशिकाओं से विकसित हो जाते हैं। इसलिए उतपरिवर्तन अध्ययन में इनका अधिक महत्व है।
(In contrast to organogenesis, somatic embryos develop from single cells. Therefore, they are more important in the study of mutation.)
· रोग मुक्त पौधे उत्पन्न किए जा सकते हैं।
(Disease-free plants can be produced.)








.bmp)